Resultados de la evaluación de seguridad de la EFSA sobre el cannabidiol como ‘alimento nuevo’ (‘novel food’)
En diciembre de 2025, el panel de la Autoridad Europea de Seguridad Alimentaria (EFSA) sobre Nutrición, Nuevos Alimentos y Alérgenos Alimentarios (NDA), publicó una revisión exhaustiva de estudios en animales y humanos publicada hasta mediados de 2024 indica que el cannabidiol (CBD) ejerce efectos biológicos medibles en múltiples sistemas orgánicos. En este completo reporte, los autores mencionan que la evidencia disponible sigue siendo heterogénea, con varias incertidumbres críticas que limitan el establecimiento de conclusiones definitivas de seguridad a largo plazo.
Contexto para la revisión.
El Reglamento (UE) 2015/2283 exige que los “alimentos novedosos” (traducción literal del término “novel food” - también conocido como “nuevos alimentos”) puestos en el mercado de la UE se sometan a una evaluación científica armonizada de seguridad por parte de la Autoridad Europea de Seguridad Alimentaria (EFSA). El cannabidiol (CBD), que no se consumía ampliamente en la UE antes de mayo de 1997, está clasificado como un “alimento novedoso”. A agosto de 2025, se han presentado más de 200 solicitudes de autorización para el CBD ante la Comisión Europea, con múltiples expedientes actualmente bajo evaluación de riesgos de la EFSA. En 2022, el Panel de NDA de EFSA concluyó que las significativas lagunas de datos e incertidumbres —especialmente en lo relativo a la toxicidad hepática, los efectos reproductivos y la exposición a largo plazo— impedían establecer la seguridad del CBD como ingrediente alimentario. A la luz de importantes nuevas publicaciones científicas desde 2021, la EFSA tuvo la tarea de actualizar su Declaración para reevaluar estas incertidumbres y determinar si se habían logrado avances.
Desde una perspectiva regulatoria, en Europa el CBD continúa sin tener autorización como Alimento Nuevo en la Unión Europea (UE), y no se han producido cambios en el estatus de autorización desde 2022. El único producto autorizado de CBD en la UE es el medicamento con receta Epidiolex para condiciones epilépticas específicas. En su revisión, el panel del EFSA menciona que los enfoques regulatorios internacionales al rededor del CBD varían considerablemente, con algunas jurisdicciones estableciendo límites provisionales de ingesta y otras rechazando autorizaciones bajo los marcos alimentarios existentes. EFSA sostiene que persisten importantes carencias de datos, especialmente en lo que respecta a la toxicidad reproductiva, la exposición crónica en poblaciones sanas y grupos vulnerables como las personas embarazadas o lactantes. En consecuencia, aún no se ha establecido la seguridad del CBD como alimento novedoso—especialmente cuando se utiliza como ingrediente alimenticio general.
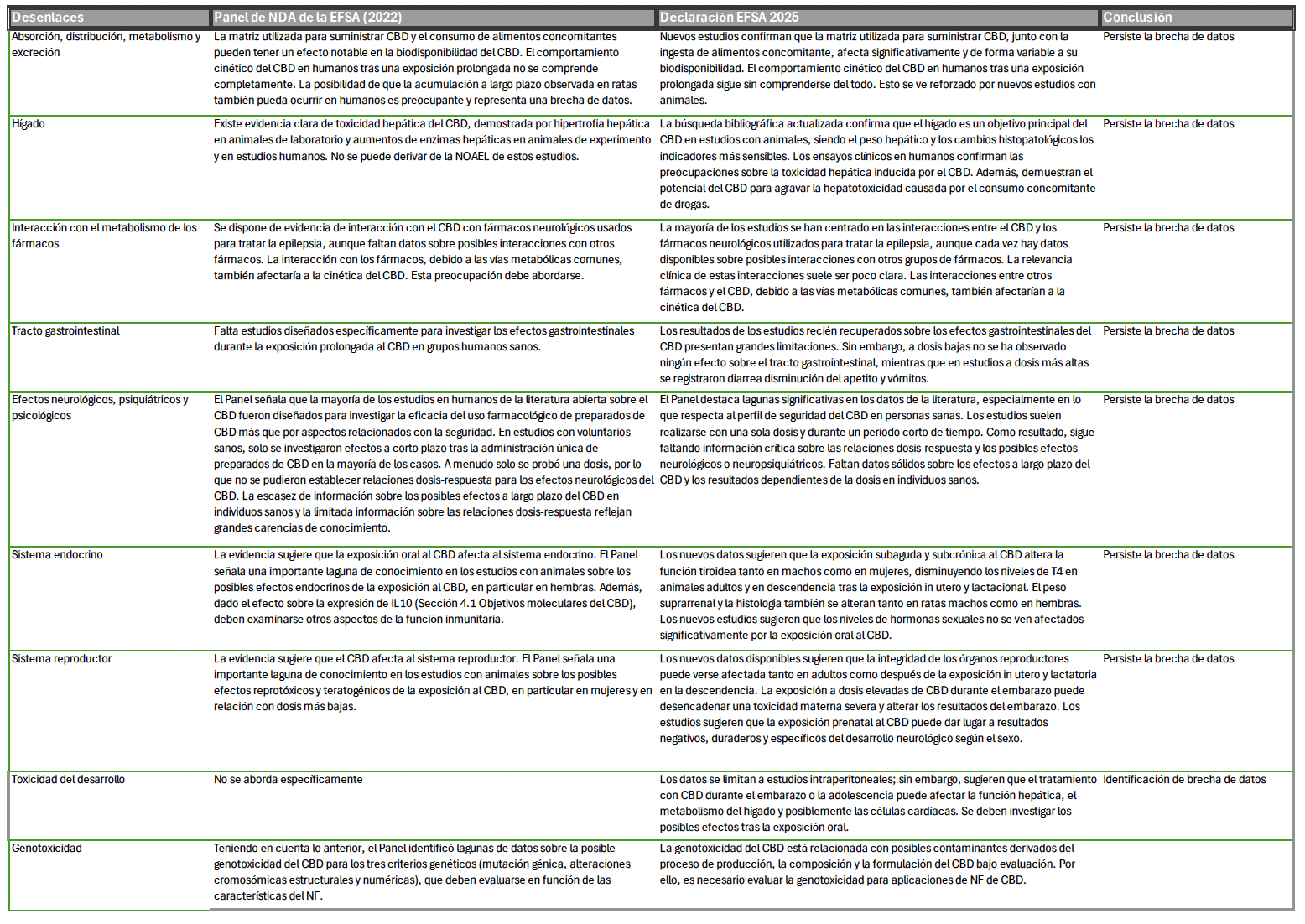
Para apoyar la actualización, EFSA realizó revisiones sistemáticas de la literatura de estudios en animales y humanos publicados entre agosto de 2021 y junio de 2024, centrándose en los criterios hepáticos, gastrointestinales, neurológicos, inmunológicos, endocrinos y reproductivos. Solo se incluyeron estudios que utilizaron CBD de alta pureza (>95%). Análisis adicionales abordaron la farmacocinética, los blancos moleculares y las posibles interacciones fármaco-fármaco. Se realizó un análisis de dosis de referencia (DMO) utilizando estudios de 90 días conformes con la normativa GLP presentados en Novel Food Applications. La declaración actualizada también establece un punto de referencia provisional para la evaluación de riesgos y ofrece orientación sobre consideraciones de formulación, incluyendo la aplicabilidad de umbrales de coeficientes de partición octanol–agua para determinar si el CBD está completamente disuelto en aceite o presente en forma de nanopartículas.
Entre los hallazgos mas notables, esto fué lo que se reveló en dicha revisión:
Efectos hepáticos
Entre los criterios evaluados, los resultados hepáticos representan la señal observada de mayor consistencia. Tanto los estudios subcrónicos en animales como los ensayos clínicos controlados en humanos demuestran elevaciones dependientes de la dosis en las enzimas hepáticas séricas, lo que sugiere un posible riesgo de daño hepatocelular a niveles de exposición más altos. Estos hallazgos parecen más evidentes con una administración prolongada y con preparaciones de CBD de alta pureza. La consistencia de las observaciones hepáticas entre los diseños de estudio contribuyó sustancialmente a la determinación del nivel provisional de ingesta segura.
Efectos gastrointestinales
El CBD suele tolerarse bien en dosis bajas; sin embargo, varios estudios informan de efectos adversos gastrointestinales, como náuseas, diarrea y alteraciones del apetito, especialmente en dosis más altas. La variabilidad en las respuestas gastrointestinales puede reflejar diferencias en la formulación, la coadministración con los alimentos y el uso simultáneo de medicación, todas ellas factores que influyen en la absorción y el metabolismo.
Efectos neurológicos
El CBD atraviesa fácilmente la barrera hematoencefálica y muestra actividad neuromoduladora. Estudios experimentales y clínicos sugieren posibles efectos sobre la coordinación motora, el rendimiento cognitivo y la arquitectura del sueño, aunque la evidencia humana actual está limitada por tamaños reducidos de muestra, cortas duraciones de exposición y variables de confusión como la coexposición a otros cannabinoides o agentes farmacológicos. En consecuencia, el perfil de seguridad neurológica a largo plazo sigue siendo insuficientemente caracterizado.
Efectos endocrinos y reproductivos
Los estudios en animales indican posibles alteraciones en el sistema endocrino y reproductivo, incluyendo cambios en las concentraciones hormonales, el peso de los órganos reproductores y parámetros relacionados con el desarrollo de gametos. Los datos humanos que abordan estos criterios son extremadamente limitados, lo que impide una caracterización fiable del riesgo, especialmente en poblaciones con mayor vulnerabilidad fisiológica, como personas embarazadas o lactantes.
Efectos inmunológicos
La evidencia sobre inmunotoxicidad sigue siendo inconclusa. Algunos estudios preclínicos sugieren una modulación inmunitaria modesta; sin embargo, no se ha establecido la importancia clínica de estos hallazgos, y los datos humanos disponibles actualmente son insuficientes para confirmar o refutar un riesgo inmunológico significativo.
Interacciones fármaco-metabólico y farmacocinética
Se ha demostrado que el CBD interactúa con enzimas metabólicas citocromo P450, creando el potencial para interacciones farmacocinéticas clínicamente relevantes con medicamentos administrados simultáneamente. Además, la exposición sistémica varía sustancialmente en función de las características de la formulación y de si la administración se realiza en estado de alimentación o en ayuno, lo que complica aún más la evaluación dosis-respuesta.
Después de este exhaustivo trabajo, el panel concluye que:
La nueva literatura publicada desde la Declaración de la EFSA sobre el CBD (Panel NDA de la EFSA, 2022) no es suficiente para abordar las lagunas de datos y las incertidumbres identificadas previamente.
Persisten las incertidumbres sobre el comportamiento cinético y los efectos del consumo a largo plazo de CBD en el hígado, las funciones neurológicas y los sistemas reproductivo e inmunitario.
Las brechas de datos relacionadas con el desarrollo neuronal son especialmente preocupantes, ya que este continúa en humanos hasta aproximadamente los 25 años de edad. Además, el CBD interactúa con enzimas que metabolizan fármacos, lo que indica un potencial de interacciones con medicamentos.
Teniendo en cuenta todo lo anterior, el panel declara que no se puede establecer la seguridad del CBD como nuevo alimento para dosis superiores a 0,0275 mg/kg de peso corporal al día, lo que corresponde a aproximadamente 2 mg/día para un adulto de 70 kg, hasta que se disponga de los datos de seguridad pertinentes. Este valor provisional se aplica a las formulaciones de CBD consumidas como complementos alimenticios con una pureza igual o superior al 98 %, cuyo proceso de producción se considera seguro, se ha descartado la genotoxicidad y no implican exposición a partículas pequeñas, incluidas las nanopartículas. No se puede determinar la seguridad del uso de CBD en menores de 25 años, mujeres embarazadas o en período de lactancia ni en quienes toman medicamentos simultáneamente.
EFSA y CBD en alimentos: lo que puede significar la cautela europea para América Latina
En los últimos años, CBD ha pasado rápidamente a los mercados convencionales de alimentos y suplementos. Sin embargo, mientras el interés del consumidor ha aumentado, los reguladores de todo el mundo han tomado caminos muy diferentes para decidir si, y cómo, el CBD puede consumirse de forma segura como parte de la dieta. Esta divergencia se observa en varias regiones del mundo, como bien lo apunta EFSA en su declaración, como también lo es en América Latina, especialmente Ecuador y Colombia.
Ecuador: acceso al mercado sin un dossier toxicológico formal
Ecuador fue el primer país que permitió los alimentos y suplementos que contienen CBD en América Latina. Tras reformas legales que distinguían el cannabis no psicoactivo de las sustancias controladas, la autoridad sanitaria nacional de Ecuador emitió normas técnicas que permitían el uso de CBD y otros derivados del cáñamo como ingredientes en alimentos procesados y suplementos dietéticos, siempre que el producto final contenga menos del 0,3% de THC.
El marco regulatorio de Ecuador está orientado a estándares de producto más que a la evaluación de riesgos. Las normas aplicables se centran en criterios de elegibilidad (como los umbrales de THC), requisitos de etiquetado y registro o notificación sanitaria. Los productos deben demostrar su cumplimiento mediante certificados de análisis y tienen prohibido hacer afirmaciones terapéuticas o de salud. Sin embargo, los textos regulatorios no hacen referencia a estudios toxicológicos publicados, ingesta diaria aceptable (IDAs) ni a una evaluación científica estructurada de riesgos que justifique la seguridad del CBD como ingrediente alimentario.
En la práctica, este enfoque ha permitido que una variedad de alimentos, bebidas y suplementos que contienen CBD entren en el mercado ecuatoriano. La supervisión de la seguridad se ejerce a nivel de producto, en lugar de mediante una evaluación integral a nivel de ingrediente comparable al proceso para alimentos nuevos, o “alimentos novedosos” de la UE.
Colombia: una justificación más explícita basada en la ciencia
El marco regulatorio colombiano permite la inclusión de derivados del cannabis no psicoactivos, incluido el CBD, en alimentos y suplementos, sujetos a límites definidos de THC y buenas prácticas de fabricación. Sin embargo, a diferencia de Ecuador, el desarrollo regulatorio de Colombia ha estado informado por un razonamiento toxicológico formal.
Los análisis de fondo que apoyan las normas colombianas se han basado en enfoques utilizados por comités de expertos británicos, que derivaron una IDA provisional para el CBD basada en estudios de toxicidad sub-crónica animal que identifican los efectos hepáticos como el punto crítico. Al aplicar factores de incertidumbre a los niveles observados de no-efecto, estas evaluaciones produjeron un valor de referencia en la ingesta que pudo utilizarse para modelar la exposición dietética. Posteriormente, se utilizaron evaluaciones probabilísticas de exposición para evaluar si las concentraciones propuestas de CBD en los alimentos superarían el IDA provisional.
El documento oficial colombiano Formato de Memoria Justificativa para el proyecto de resolución “Por la cual se establecen las condiciones sanitarias de los alimentos que contienen Cannabidiol (CBD) destinados al consumo humano y se dictan otras disposiciones” menciona, a partir de los estudios llevados a cabo en el Reino Unido que “El uso crónico (asumiendo un consumo diario a lo largo de toda la vida) de CBD puro aún no ha sido completamente evaluado de forma científica y rigurosa, en consecuencia, no es posible asegurar que el consumo crónico en niveles de ingesta superiores a 10 mg de CBD al día sean seguros y existe una duda razonable de que puedan contribuir al desarrollo de efectos adversos a lo largo del tiempo, principalmente en el hígado”
Esta metodología refleja un paradigma tradicional de evaluación toxicológica del riesgo: identificar peligros, derivar un punto de partida, aplicar factores de incertidumbre y comparar la exposición estimada con un punto de referencia. Aunque las regulaciones de Colombia continúan evolucionando —incluyendo discusiones sobre límites explícitos de concentración de CBD— la lógica subyacente es científica, aunque se base en datos incompletos.
¿Qué significa la cautela de EFSA para América Latina?
Aunque las últimas declaraciones de EFSA no invalidan directamente las decisiones regulatorias tomadas por Ecuador o Colombia, sí ponen el foco en las incertidumbres científicas globales al respecto de la seguridad de la inclusión del CBD en alimentos. Las preocupaciones sobre la toxicidad hepática, la exposición prolongada y las poblaciones vulnerables no son exclusivas de Europa, aunque Europa haya optado por una respuesta regulatoria más cautelosa.
Para Ecuador, la postura de la EFSA pone de manifiesto una brecha estructural, pues el CBD está permitido en alimentos sin una justificación toxicológica o un referente de ingesta públicamente articulado. Aunque los controles de productos y los límites de THC gestionan el riesgo de psicoactividad, no abordan los efectos sistémicos relacionados con la dosis identificados en la literatura científica. Los resultados de trabajos como el de la EFSA debería sugerir que las jurisdicciones que dependen únicamente de estándares de productos podrían considerar medidas adicionales de comunicación de riesgos, orientación para la admisión o vigilancia post-comercialización.
Para Colombia, la postura de EFSA desafía la suficiencia de los enfoques basados en IDAs existentes. El nivel de ingesta provisional mucho más bajo de EFSA —y su insistencia en que la seguridad aún no puede estar completamente establecida— pone de manifiesto el grado de incertidumbre inherente a confiar únicamente en estudios sub-crónicos. Esto ilustra la tensión entre el acceso al mercado gestionado por riesgos y la evaluación del riesgo.
En conjunto, estos enfoques contrastantes revelan una elección política fundamental a la que se enfrentan los reguladores de todo el mundo. El modelo europeo prioriza la certeza científica antes de la autorización, incluso a costa de retrasar el acceso al mercado. El marco de Ecuador prioriza el control regulatorio y la no psicoactividad, lo que permite una rápida comercialización. Colombia busca un punto intermedio, utilizando la toxicología disponible para gestionar el riesgo y reconociendo la incertidumbre.
Las declaraciones de la EFSA resaltan un punto claro, y es que a pesar de la popularidad del CBD, la base científica de seguridad como un complemento alimentario sigue siendo incompleta. A medida que los mercados latinoamericanos maduran y el comercio internacional de productos de CBD se expande, la cuestión no es si las conclusiones de la EFSA se aplican fuera de Europa, sino cuánto peso deciden darles otros reguladores. En ese sentido, la cautela de la EFSA puede servir menos como barrera y más como punto de referencia, y como un recordatorio de que el permiso regulatorio no equivale automáticamente a certeza científica.